Estas moléculas pueden dividirse en los denominados átomos y estos en particulas aun menores denominadas electrones, protones y neutrones.

Los protones y neutrones se encuentran inmóviles en la zona interior, en el denominado núcleo del átomo, mientras los electrones orbitan alrededor del nucleo.
Los electrones disponen de la misma carga eléctrica que los protones, pero de signo contrario, siendo este equilibrio de cargas el que mantiene unidas las partículas que forman el átomo. Sin embargo, debido a la distancia que separa a los electrones del nucleo, y su movimiento orbital, es relativamente fácil romper este equilibrio. Aplicando energía desde el exterior podemos desprender electrones del átomo.
Por ejemplo:
Si en un átomo de Litio, la suma de cargas eléctricas es nula.
3(+) + 3(-) = 0
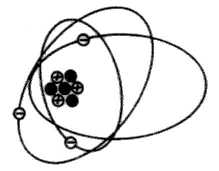
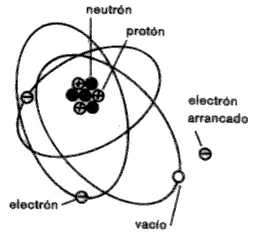
Si, suponiendo que por frotamiento, conseguimos transmitirle la sufiente energía como para arrancarle un electrón, el equilibrio de cargas eléctricas se pierde, ahora el átomo contiene 3 protones y 2 electrones.
3(+) + 2(-) = 1(+)
 |
=> |
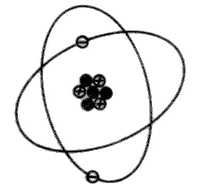 |
En este caso se dice que el átomo queda cargado positivamente (catión o ión positivo).
Del mismo modo si lo que se consigue es añadir un electrón al átomo, este quedaría cargado negativamente (anión o ión negativo).
3(+) + 4(-) = 1 (-)
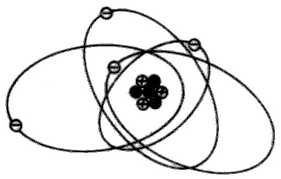
De esta manera, quitando o añadiendo electrones, se electriza el átomo y como consecuencia el material formado por infinidad de átomos.
La medida física que indica el exceso o defecto de electrones en un cuerpo se la denomina carga eléctrica. Se mide en Culombios. Un Culombio es la carga eléctrica equivalente a 6.300.000.000.000.000.000 electrones.
Fuente www.electricoweb.com